Eine Auswahl
Auslesezüchtung (seit etwa 12 00 Jahren)
Der Mensch wählte die Pflanzen mit den gewünschten Eigenschaften aus und nimmt nur deren Samen für die Vermehrung. Zeitaufwand: sehr langwierig (viele Jahrzehnte), nur seltene und ungezielte Verbesserungen.
Kreuzungszüchtung (seit dem 19. Jahrhundert)
Zwei artverwandte Pflanzen, die unterschiedliche gewünschte Eigenschaften haben, werden miteinander zur Fortpflanzung gebracht, oft durch manuelle Bestäubung. Zeitaufwand: langwierig, je nach Pflanzenart 5 bis 30 Jahre.
Mutationszüchtung (seit 1930)
Die natürliche Mutationsrate wird durch ionisierende Strahlung oder bestimmte Chemikalien künstlich um ein Vielfaches erhöht. Zeitaufwand: langwierig, da ungezielt; die behandelten Pflanzen müssen vielfach mit der ursprünglichen Pflanzlinie rückgekreuzt werden, um Mutationsschäden zu eliminieren.
Transgene Pflanzen (seit 1983)
DNA aus artfremden Organismen (aus Bakterien, Tieren oder anderen Pflanzen) wird in das Erbgut der Pflanzen eingebracht. Dies geschieht durch Hilfsorganismen wie Viren und Agrobakterien oder durch Beschießen der Pflanze mit kleinen Gold- oder Wolframpartikeln, auf denen sich die DNA befindet. Zeitaufwand: schneller und gezielter als konventionelle Methoden; es wird nur wenig fremde DNA eingebaut, allerdings ungezielt.
Genomeditierung (seit 1996)
SDN1-Verfahren: Enzyme, die in der Pflanze eingebracht werden, zerschneiden die DNA gezielt an einer auswählbaren Stelle; die Zelle repariert den Schnitt, wobei durch seltene Fehler bei der Reparatur kleine Veränderungen entstehen.
SDN2-Verfahren: Wie SDN1, aber es wird eine Sequenzvorlage für die Reparatur angeboten, wodurch eine etwas größere Veränderung nach Wunsch erzeugt wird.
SDN3- Verfahren: Funktionieren im Prinzip wie SDN2, es werden aber deutlich größere Sequenzvorlagen in die Zelle eingebracht, das heißt, relativ lange Gensequenzen lassen sich in den Organismus integrieren.
Zeitaufwand: schneller und gezielter als konventionelle Zuchtmethoden.
SMART-Züchtung (seit 2009) und
Genomic Selection
Wichtige Phänotypische Merkmale werden mit typischen Sequenzregionen
(Markern) in den Erbanlagen einer Nutzpflanzenart in Verbindung gebracht. Anhand dessen kann man die Kreuzungspartner gezielt auswählen und deren Nachkommen bereits im frühen Wachstumsstadium auf die gewünschte Sequenzkombinationen im Erbgut hin untersuchen. Die Erbanlagen werden dabei nicht verändert, und die spezifische Funktion der Gene, in deren Nähe die aufgespürten Sequenzregionen liegen, ist häufig noch unbekannt.
Genomic Selection nutzt Informationen zu allen molekularen Markern einer Population und zur Qualität der mit ihnen verbundenen Merkmale, um daraus eine Züchtungsstrategie für komplexe Kombinationen von Eigenschaften zu entwickeln. Zeitaufwand: schneller als konventionelle Methoden, da die Auswahl der Eltern und der Nachkommen im frühen Wachstumsstadium auf der Ebene von molekularen Markern erfolgt.
Einsatzbeispiele klassischer und neuer
Molekulargenetischer Züchtungsverfahren
Klimaanpassung
Angesichts des Klimawandels hoffen viele darauf, dass moderne Züchtungsverfahren dazu beitragen, Kulturpflanzen zu entwickeln, die Trockenheit besser tolerieren. Tatsächlich sind mittlerweile einige transgene trockenstresstoleranter Sorten auf dem Markt verfügbar. Als besonders widerstandsfähig gegenüber Wassermangel hat sich eine transgene Weizenlinie der Firma Bioceres (Argentinien) erwiesen, der HB4-Weizen. Er lässt unter Trockenstress je nach Standort bis zu 20 Prozent mehr Ertrag erwarten und liefert unter normalen Bedingungen gleichwertige Erträge wie konventionelle Sorten. Seine Trockentoleranz beruht auf der Wirkung eines stressregulierenden Gens aus der Sonnenblume, das die zellabbauenden Prozesse (Seneszenz) bei Trockenheit verlangsamt. Die Entwicklungszeit bis zur Zulassung in Argentinien betrug 15 Jahre. Derzeit bemüht sich Bioceres um eine breite internationale Zulassung. Es gibt auch Versuche, trockentolerante Nutzpflanzen per Genomeditierung zu erzeugen, sie haben aber noch kein marktreifes Produkt hervorgebracht.
Domestikation neuer Kulturen
Genomeditierung gilt als vielversprechendes Werkzeug, wenn es darum geht, neue Kulturpflanzen zu domestizieren, also landwirtschaftlich nutzbar zu machen. Einer der Gründe dafür lautet, dass Genomeditierung die gleichzeitige Veränderung mehrere Zielgene ermöglicht. Das prinzipielle Vorgehen verdeutlicht eine Forschergruppe unter der Beteiligung der Westfälischen Wilhelms-Universität Münster an der Urform der Kulturtomate. Die Wissenschaftler veränderten die Wildpflanze mithilfe des CRISPER-Cas-Systems so, dass die Tochterpflanzen kleine genetische Veränderungen an sechs Genen trugen (Multiplexing). So ließen sich entscheidende Schritte der Tomaten-Domestikation wiederholen: viel und größere Früchte, kompakterer Wuchs. Zusätzlich wurde der Gehalt an dem Antioxidans Lycopin erhöht.
Ein markantes Beispiel…
… für die Kombination unterschiedlicher Züchtungsmethoden einschließlich transgener Verfahren und Genomeditierung liefert die Firma Cover Cress (USA).
Sie hat das Acker-Hellerkraut, das als „Unkraut“ gilt, zu einer Öl- und Futterpflanze umgewandelt, die sich als Winterzwischenfrucht für Mais-Soja-Fruchtfolgen in den USA nutzen lässt. Hierfür musste unter anderem die Blühphase und die Ölzusammensetzung angepasst werden. Das gelang, indem man die störenden Inhaltstoffe beseitigt werden. Das gelang, indem man die dafür jeweils verantwortlichen Gene identifizierte und veränderte. Als hilfreich erwies sich dabei die enge Verwandtschaft mit der Ackerschmalwand (Arabidopsis thaliana), die als Modellpflanze in der Pflanzenforschung ausgiebig untersucht und auch genetisch detailliert beschrieben ist. Sie dient als Blaupause für einige Genmodifikationen des Acker-Hellerkrauts. Insgesamt dauerte die Entwicklung bis zur Marktreife mehr als 10 Jahre.
Regulierung von genomeditierten Pflanzen
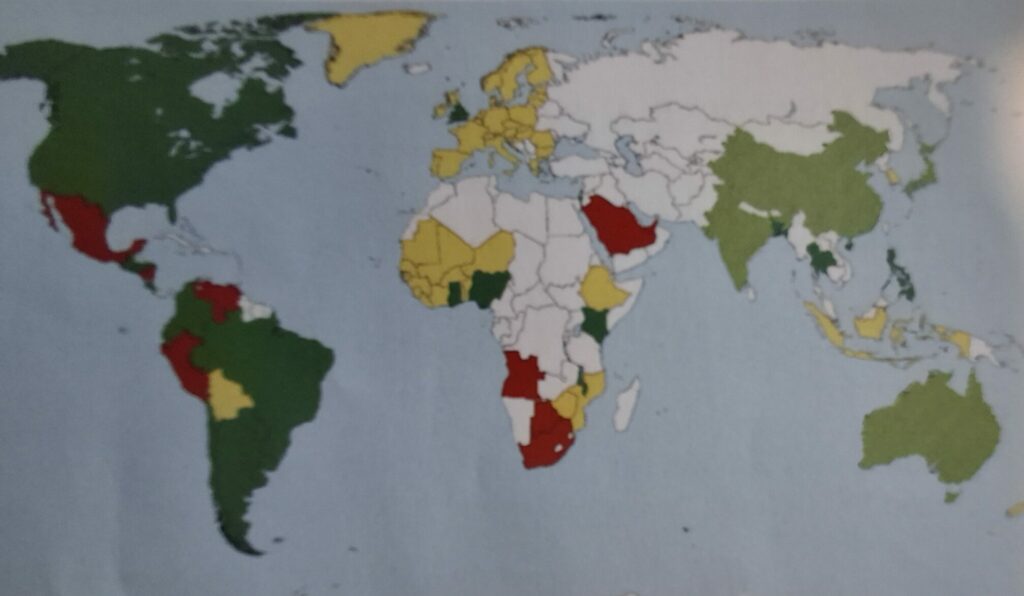
Darstellung der bestehenden Regulierungen und derzeitigen Regulierungsvorschläge, die sich auf genomeditierten Pflanzen bezieht.
Grün: Länder, in denen Pflanzen, die mit neuen genomischen Techniken (NGT) verändert wurden, weitgehend wie herkömmlich gezüchtete reguliert werden.
Gelb-grün schraffiert: Staaten, in denen NGT-Pflanzen besonderen Regulierungen unterliegen und teilweise von der Behandlung als gentechnisch veränderte Organismen (GVO) ausgenommen sind. Je nach Land gelten spezifische Anforderungen.
Gelb: Länder, in denen der rechtliche Status von NGT-Pflanzen noch diskutiert wird.
Rot: Staaten mit strenger Regulierung für NGT-Pflanzen, ähnlich der von GVO.
Wieß: keine Informationen zur Regulierung von NGT.
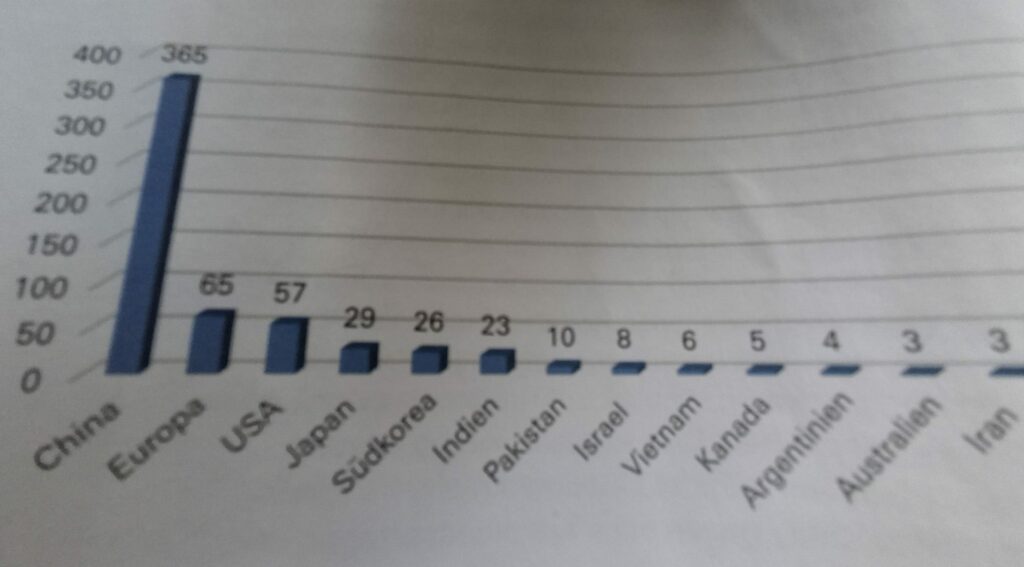
ANWENDUNG DES GENOME EDITING BEI PFLANZEN
Publizierte wissenschaftliche Arbeiten, die von Anwendung der Genomeditierung bei Pflanzen handeln, im Zeitraum zwischen August 2019 und Juni 2024. Die Grafik erfasst nur solche Publikationen, die über rein experimentelle Arbeiten hinausgehen. China hat rund 60 Prozent aller einschlägigen Anwendungen veröffentlicht und führt damit deutlich.
Vielgenutztes Gewächs
Ein Feldversuch mit Maispflanzen. Mais dient nicht nur als Nahrungspflanze, sondern auch als Grundlage für Viehfutter sowie als nachwachsender Rohstoff für die Energiegewinnung. Als C4-Pflanze kommt er vergleichsweise gut mit längeren Trockenperioden zurecht, was ihn als Ackerpflanze in Zeiten des Klimawandels interessant macht. Diverse gentechnisch veränderte Maissorten sind in Europa für den Anbau zugelassen. Die Entwicklung des Bt-Maises, dem ein bakterielles Gen für ein Insektentoxin eingebaut wurde, war aus wissenschaftlicher Sicht ein Durchbruch.
MO
Quellen:
Europäische Kommission: Proposal for a Regulation of the European Parliament and of the Council on plants obtained by certain new genomic techniques and their food and feed, and amending Regulation (EU)2017/625, Brüssel, 2023
Europäische Kommission:Study on the status of new genomic techniques under Union law andin light of the Court of Justice ruling in Case C-528/16. Brüssel, 2021
Spektrum der Wissenschaft, 11/25
